
Όλα τα περιεχόμενα του iLive ελέγχονται ιατρικά ή ελέγχονται για να διασφαλιστεί η όσο το δυνατόν ακριβέστερη ακρίβεια.
Έχουμε αυστηρές κατευθυντήριες γραμμές προμήθειας και συνδέουμε μόνο με αξιόπιστους δικτυακούς τόπους πολυμέσων, ακαδημαϊκά ερευνητικά ιδρύματα και, όπου είναι δυνατόν, ιατρικά επισκοπικά μελέτες. Σημειώστε ότι οι αριθμοί στις παρενθέσεις ([1], [2], κλπ.) Είναι σύνδεσμοι με τις οποίες μπορείτε να κάνετε κλικ σε αυτές τις μελέτες.
Εάν πιστεύετε ότι κάποιο από το περιεχόμενό μας είναι ανακριβές, παρωχημένο ή αμφισβητήσιμο, παρακαλώ επιλέξτε το και πατήστε Ctrl + Enter.
Η μετάλλαξη του γονιδίου ARID1A καθιστά τους όγκους ευαίσθητους στην ανοσοθεραπεία
Τελευταία επισκόπηση: 02.07.2025

Η ανοσοθεραπεία έχει φέρει επανάσταση στη θεραπεία του καρκίνου τα τελευταία χρόνια. Αντί να στοχεύει άμεσα τους όγκους, η ανοσοθεραπεία κατευθύνει το ανοσοποιητικό σύστημα των ασθενών να επιτίθενται στους όγκους πιο αποτελεσματικά. Αυτό είναι ιδιαίτερα αποτελεσματικό για ορισμένους καρκίνους που είναι δύσκολο να αντιμετωπιστούν. Ωστόσο, λιγότεροι από τους μισούς ασθενείς με καρκίνο ανταποκρίνονται στις τρέχουσες ανοσοθεραπείες, δημιουργώντας επείγουσα ανάγκη για τον εντοπισμό βιοδεικτών που μπορούν να προβλέψουν ποιοι ασθενείς είναι πιο πιθανό να ωφεληθούν από τη θεραπεία.
Πρόσφατα, οι επιστήμονες παρατήρησαν ότι οι ασθενείς των οποίων οι όγκοι έχουν μετάλλαξη στο γονίδιο ARID1A είναι πιο πιθανό να ανταποκριθούν θετικά στον αποκλεισμό των σημείων ελέγχου του ανοσοποιητικού συστήματος, έναν τύπο ανοσοθεραπείας που λειτουργεί διατηρώντας ενεργοποιημένα τα ανοσοκύτταρα που καταπολεμούν τον καρκίνο.
Επειδή η μετάλλαξη του γονιδίου ARID1A υπάρχει σε πολλούς καρκίνους, συμπεριλαμβανομένων των καρκίνων του ενδομητρίου, των ωοθηκών, του παχέος εντέρου, του στομάχου, του ήπατος και του παγκρέατος, οι ερευνητές του Ινστιτούτου Salk αναρωτήθηκαν πώς θα μπορούσε να συμβάλει στην ευαισθησία της θεραπείας και πώς οι κλινικοί γιατροί θα μπορούσαν να χρησιμοποιήσουν αυτές τις πληροφορίες για να εξατομικεύσουν τη θεραπεία του καρκίνου για κάθε ασθενή.
Η νέα τους μελέτη, που δημοσιεύτηκε στο περιοδικό Cell, δείχνει ότι η μετάλλαξη ARID1A καθιστά τους όγκους ευαίσθητους στην ανοσοθεραπεία, στρατολογώντας ανοσοκύτταρα που καταπολεμούν τον καρκίνο στον όγκο μέσω μιας ανοσολογικής απόκρισης που μοιάζει με αντιιική.
Οι ερευνητές προτείνουν ότι αυτή η μετάλλαξη και η αντιιική ανοσολογική απόκριση θα μπορούσαν να χρησιμοποιηθούν ως βιοδείκτης για την καλύτερη επιλογή ασθενών για συγκεκριμένες ανοσοθεραπείες, όπως ο αποκλεισμός των ανοσοποιητικών σημείων ελέγχου. Αυτά τα ευρήματα ενθαρρύνουν επίσης την ανάπτυξη φαρμάκων που στοχεύουν το ARID1A και τις σχετικές πρωτεΐνες για να κάνουν άλλους όγκους πιο ευαίσθητους στην ανοσοθεραπεία.
«Αυτό θα μπορούσε πραγματικά να αλλάξει το αποτέλεσμα της θεραπείας του καρκίνου για τους ασθενείς», δήλωσε η Αναπληρώτρια Καθηγήτρια Νταϊάνα Χάργκριβς, επικεφαλής συγγραφέας της μελέτης. «Οι ασθενείς με τη μετάλλαξη ARID1A έχουν ήδη μια ανοσολογική απόκριση, επομένως το μόνο που χρειάζεται να κάνουμε είναι να ενισχύσουμε αυτήν την απόκριση με ανοσολογικό αποκλεισμό σημείων ελέγχου για να τους βοηθήσουμε να καταστρέψουν τους όγκους τους από μέσα».
Παρόλο που ήταν γνωστό ότι άτομα με μεταλλάξεις ARID1A ανταποκρίθηκαν καλά στον αποκλεισμό των σημείων ελέγχου του ανοσοποιητικού συστήματος, η ακριβής σύνδεση μεταξύ των δύο παρέμεινε ασαφής. Για να ρίξουν φως στον μηχανισμό, επιστήμονες στο Ινστιτούτο Salk χρησιμοποίησαν μοντέλα ποντικών μελανώματος και καρκίνου του παχέος εντέρου τόσο με τη μετάλλαξη ARID1A όσο και με λειτουργικό ARID1A.
Πηγή: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Η ομάδα παρατήρησε μια ισχυρή ανοσολογική απόκριση σε όλα τα μοντέλα με τη μετάλλαξη ARID1A, αλλά όχι σε εκείνα όπου το ARID1A ήταν λειτουργικό, υποστηρίζοντας την ιδέα ότι η μετάλλαξη ARID1A πράγματι προκαλεί αυτήν την απόκριση. Πώς όμως λειτουργεί αυτό σε μοριακό επίπεδο;
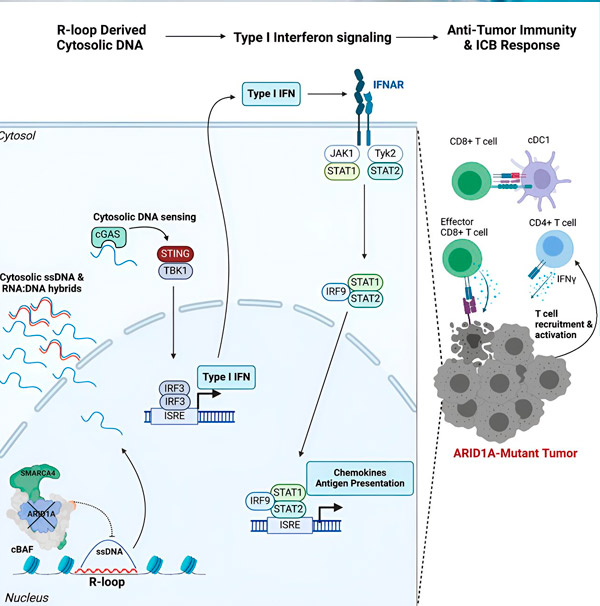
«Διαπιστώσαμε ότι το ARID1A παίζει σημαντικό ρόλο στον πυρήνα διατηρώντας την σωστή οργάνωση του DNA», λέει ο Matthew Maxwell, πρώτος συγγραφέας της μελέτης και μεταπτυχιακός φοιτητής στο εργαστήριο Hargreaves. «Χωρίς λειτουργικό ARID1A, το ελεύθερο DNA μπορεί να αποκοπεί και να απελευθερωθεί στο κυτταρόπλασμα, ενεργοποιώντας μια επιθυμητή αντιιική ανοσοαπόκριση που μπορεί να ενισχυθεί με αποκλεισμό σημείων ελέγχου του ανοσοποιητικού συστήματος».
Το γονίδιο ARID1A κωδικοποιεί μια πρωτεΐνη που βοηθά στη ρύθμιση του σχήματος του DNA μας και στη διατήρηση της σταθερότητας του γονιδιώματος. Όταν το γονίδιο ARID1A μεταλλάσσεται, ενεργοποιεί μια αλυσίδα γεγονότων τύπου Rube Goldberg στα καρκινικά κύτταρα.
Καταρχάς, η έλλειψη λειτουργικού ARID1A έχει ως αποτέλεσμα την απελευθέρωση DNA στο κυτταρόπλασμα. Το κυτταροπλασμικό DNA στη συνέχεια ενεργοποιεί ένα αντιιικό σύστημα συναγερμού, την οδό cGAS-STING, επειδή τα κύτταρά μας είναι προσαρμοσμένα να χαρακτηρίζουν οποιοδήποτε DNA στο κυτταρόπλασμα ως ξένο για προστασία από ιογενείς λοιμώξεις. Τελικά, η οδός cGAS-STING εμπλέκει το ανοσοποιητικό σύστημα για να στρατολογήσει Τ κύτταρα στον όγκο και να τα ενεργοποιήσει σε εξειδικευμένα Τ κύτταρα-δολοφόνους καρκίνου.
Σε κάθε βήμα, ανάλογα με το προηγούμενο, αυτή η αλυσίδα γεγονότων - μετάλλαξη ARID1A, διαφυγή DNA, συναγερμός cGAS-STING, στρατολόγηση Τ-κυττάρων - οδηγεί σε αύξηση του αριθμού των Τ κυττάρων που καταπολεμούν τον καρκίνο στον όγκο. Ο ανοσοποιητικός αποκλεισμός σημείων ελέγχου μπορεί στη συνέχεια να χρησιμοποιηθεί για να διασφαλιστεί ότι αυτά τα Τ κύτταρα παραμένουν ενεργοποιημένα, ενισχύοντας την ικανότητά τους να νικούν τον καρκίνο.
«Τα ευρήματά μας παρέχουν έναν νέο μοριακό μηχανισμό μέσω του οποίου μια μετάλλαξη ARID1A μπορεί να συμβάλει σε μια αντικαρκινική ανοσοαπόκριση», λέει ο Hargreaves. «Αυτό που είναι συναρπαστικό σε αυτά τα ευρήματα είναι το μεταφραστικό τους δυναμικό. Μπορούμε να χρησιμοποιήσουμε τις μεταλλάξεις ARID1A για να επιλέξουμε ασθενείς για αποκλεισμό ανοσολογικών σημείων ελέγχου και τώρα βλέπουμε έναν μηχανισμό μέσω του οποίου φάρμακα που αναστέλλουν το ARID1A ή το πρωτεϊνικό του σύμπλεγμα θα μπορούσαν να χρησιμοποιηθούν για την περαιτέρω ενίσχυση της ανοσοθεραπείας σε άλλους ασθενείς».
Περιγράφοντας τον μηχανισμό με τον οποίο ο ανοσολογικός αποκλεισμός των σημείων ελέγχου είναι πιο αποτελεσματικός σε καρκίνους με μετάλλαξη ARID1A, οι ερευνητές παρέχουν στους κλινικούς ιατρούς μια λογική βάση για την ιεράρχηση αυτής της ανοσοθεραπείας για ασθενείς με μετάλλαξη ARID1A. Αυτά τα ευρήματα αποτελούν ένα σημαντικό βήμα προς την εξατομίκευση της θεραπείας του καρκίνου και εμπνέουν την ανάπτυξη νέων θεραπειών που στοχεύουν το ARID1A και το πρωτεϊνικό του σύμπλεγμα.
Στο μέλλον, η ομάδα του Ινστιτούτου Salk ελπίζει ότι τα ευρήματά τους θα βελτιώσουν τα αποτελέσματα της θεραπείας για ασθενείς με διάφορους τύπους καρκίνου που σχετίζονται με μεταλλάξεις ARID1A και σκοπεύει να διερευνήσει αυτήν την κλινική ερμηνεία σε συνεργασία με το Πανεπιστήμιο της Καλιφόρνια στο Σαν Ντιέγκο.
